Erblicher Nichtpolypose-Darmkrebs ((HNPCC), auch genannt Lynch-Syndromist eine autosomal dominante genetische Erkrankung, die mit einem hohen Risiko für Darmkrebs sowie anderen Krebsarten verbunden ist, einschließlich Endometriumkrebs (zweithäufigster Krebs), Eierstock, Magen, Dünndarm, hepatobiliärer Trakt, oberer Harntrakt, Gehirn und Haut. Das erhöhte Risiko für diese Krebsarten ist auf vererbte Mutationen zurückzuführen, die die Reparatur von DNA-Fehlpaarungen beeinträchtigen. Es ist eine Art von Krebssyndrom.
Symptome des Lynch-Syndroms
Krebsrisiko
Lebenszeitrisiko und Durchschnittsalter bei Diagnose von Krebserkrankungen im Zusammenhang mit dem Lynch-Syndrom
| Art des Krebses | Lebenslängliches Risiko (%) | Durchschnittsalter bei Diagnose (Jahre) |
| Kolorektal | 52-58 | 44-61 |
| Endometrium | 25-60 | 48-62 |
| Magen | 6-13 | 56 |
| Eierstock | 4-12 | 42.5 |
Zusätzlich zu den in der obigen Tabelle aufgeführten Krebsarten trägt das Lynch-Syndrom auch zu einem erhöhten Risiko für Dünndarmkrebs, Bauchspeicheldrüsenkrebs, Harnleiter- / Nierenbeckenkrebs, Gallenwegskrebs, Hirntumor und Talgneoplasmen bei. Ein erhöhtes Risiko für Prostatakrebs und Brustkrebs wurde auch mit dem Lynch-Syndrom in Verbindung gebracht, obwohl diese Beziehung nicht vollständig verstanden wird.
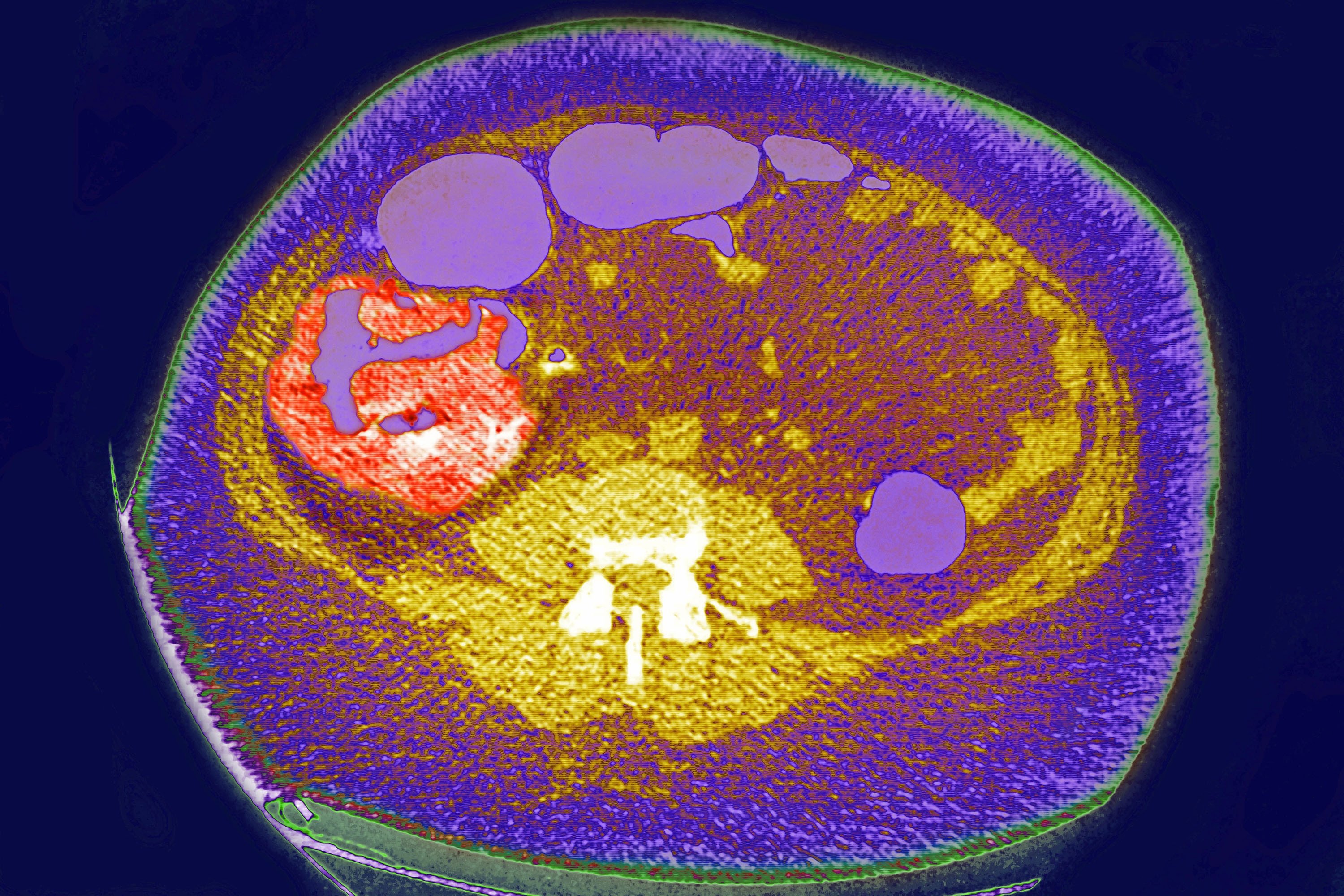
Zwei Drittel der Dickdarmkrebserkrankungen treten im proximalen Dickdarm auf. Häufige Anzeichen und Symptome sind Blut im Stuhl, Durchfall oder Verstopfung sowie unbeabsichtigter Gewichtsverlust. Das Durchschnittsalter für die Diagnose von Darmkrebs beträgt 44 Jahre für Familienmitglieder, die die Amsterdamer Kriterien erfüllen. Das durchschnittliche Diagnosealter für Endometriumkarzinom liegt bei 46 Jahren. Bei Frauen mit HNPCC, die sowohl an Dickdarm- als auch an Endometriumkrebs leiden, tritt etwa die Hälfte zuerst mit Endometriumkrebs auf, was Endometriumkrebs zum häufigsten Sentinel-Krebs beim Lynch-Syndrom macht. Das häufigste Symptom für Endometriumkarzinom ist eine abnormale Vaginalblutung. Bei HNPCC liegt das mittlere Diagnosealter für Magenkrebs bei 56 Jahren, wobei das Adenokarzinom vom Darmtyp die am häufigsten berichtete Pathologie ist. HNPCC-assoziierte Ovarialkarzinome haben ein durchschnittliches Diagnosealter von 42,5 Jahren; Etwa 30% werden vor dem 40. Lebensjahr diagnostiziert.
In Abhängigkeit von der beteiligten Mutation wurde eine signifikante Variation der Krebsrate festgestellt. Bis zum Alter von 75 Jahren waren die Risiken für Darmkrebs, Endometriumkrebs, Eierstockkrebs, oberen Magen-Darm- (Magen-, Zwölffingerdarm-, Gallengang- oder Bauchspeicheldrüsenkrebs), Harnwegskrebs, Prostatakrebs und Hirntumoren wie folgt: Für MLH1-Mutationen das Risiko betrug 46%, 43%, 10%, 21%, 8%, 17% bzw. 1%; für MSH2-Mutationen betrugen die Risiken 57%, 17%, 10%, 25%, 32% bzw. 5%; Für MSH6-Mutationen betrugen die Risiken 15%, 46%, 13%, 7%, 11%, 18% bzw. 1%.
| Gen | Eierstockkrebsrisiko | Risiko für Gebärmutterschleimhautkrebs |
|---|---|---|
| MLH1 | 4-24% | 25-60% |
| MSH2 / EPCAM | 4-24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (kombiniertes Risiko) | 15% |
Genetik

HNPCC wird autosomal-dominant vererbt. Das Kennzeichen von HNPCC ist die fehlerhafte Reparatur von DNA-Fehlpaarungen, die eine erhöhte Rate an Einzelnukleotidänderungen und Mikrosatelliteninstabilität verursacht, auch bekannt als MSI-H (das H ist „hoch“). MSI ist in Krebsproben im Pathologielabor identifizierbar. Die meisten Fälle führen zu Änderungen der Länge der Dinukleotid-Wiederholungen der Nukleobasen Cytosin und Adenin (Sequenz: CACACACACA…).
Die 4 Hauptgene, die an HNPCC beteiligt sind, kodieren normalerweise für Proteine, die Dimere bilden, um zu funktionieren:
- Das MLH1-Protein dimerisiert mit dem PMS2-Protein unter Bildung von MutLα, das die Bindung anderer an der Fehlpaarungsreparatur beteiligter Proteine wie DNA-Helikase, einzelsträngiges DNA-Bindungsprotein (RPA) und DNA-Polymerasen koordiniert.
- MSH2-Protein dimerisiert mit MSH6-Protein, das Fehlpaarungen über ein Sliding-Clamp-Modell identifiziert, ein Protein zum Scannen auf Fehler.
Die Beeinträchtigung eines der beiden Gene für das Proteindimer beeinträchtigt die Proteinfunktion. Diese 4 Gene sind an der Fehlerkorrektur (Fehlpaarungsreparatur) beteiligt, sodass eine Funktionsstörung der Gene dazu führen kann, dass DNA-Replikationsfehler nicht behoben werden können und HNPCC verursacht wird. Es ist bekannt, dass HNPCC mit anderen Mutationen in Genen assoziiert ist, die am Reparaturweg für DNA-Fehlpaarungen beteiligt sind:
| OMIM-Name | An HNPCC beteiligte Gene | Häufigkeit von Mutationen in HNPCC-Familien | Ort | Erstveröffentlichung |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | ungefähr 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | ungefähr 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | relativ selten | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | Fallbericht | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | Fallbericht | 3p22 | |
| HNPCC7 | MLH3 | umstritten | 14q24.3 |
Die meisten Menschen mit HNPCC erben die Krankheit von einem Elternteil. Aufgrund unvollständiger Penetranz, variablem Alter der Krebsdiagnose, Verringerung des Krebsrisikos oder frühem Tod haben jedoch nicht alle Menschen mit einer HNPCC-Genmutation einen Elternteil, der Krebs hatte. Einige Menschen entwickeln HNPCC de novo in einer neuen Generation, ohne das Gen zu erben. Diese Personen werden oft erst nach der Entwicklung eines Darmkrebses im frühen Leben identifiziert. Eltern mit HNPCC haben eine 50% ige Chance, die genetische Mutation an jedes Kind weiterzugeben. Es ist auch wichtig anzumerken, dass eine schädliche Mutation in einem der MMR-Gene allein nicht ausreicht, um Krebs zu verursachen, sondern dass weitere Mutationen in anderen Tumorsuppressorgenen auftreten müssen.
Diagnose des Lynch-Syndroms
Eine Diagnose des Lynch-Syndroms wird bei Personen mit einer Keimbahn-DNA-Mutation in einem der MMR-Gene (MLH1, MSH2, MSH6 und PMS2) oder dem EPCAM-Gen angewendet, die durch Gentests identifiziert wurden. Kandidaten für Keimbahn-Gentests können anhand klinischer Kriterien wie der Amsterdam Clinical Criteria und der Bethesda Guidelines oder durch Tumoranalyse durch Immunhistochemie (IHC) oder Mikrosatelliteninstabilitätstests (MSI) identifiziert werden. In den USA empfehlen Fachgesellschaften, jeden Darmkrebs als Screening auf Lynch-Syndrom auf MSI oder IHC zu testen. Dies wird jedoch aus Kosten- und Ressourcengründen nicht immer durchgeführt. Gentests sind im Handel erhältlich und bestehen aus einer Blutuntersuchung.
Immunhistochemie
Die Immunhistochemie (IHC) ist eine Methode, mit der die Expression von Proteinen mit abnormaler Fehlpaarungsreparatur (MMR) in Tumoren nachgewiesen werden kann, die mit dem Lynch-Syndrom assoziiert sind. Es ist zwar keine Diagnose eines Lynch-Syndroms, kann jedoch eine Rolle bei der Identifizierung von Personen spielen, bei denen Keimbahnuntersuchungen durchgeführt werden sollten. Zwei Methoden zur Implementierung von IHC-Tests umfassen altersbasierte Tests und universelle Tests für alle Personen. Derzeit gibt es keine weit verbreitete Übereinstimmung darüber, welche Screening-Methode angewendet werden sollte. Altersbasierte Tests auf IHC wurden teilweise aufgrund von Kosten-Nutzen-Analysen vorgeschlagen, während universelle Tests für alle Menschen mit Darmkrebs sicherstellen, dass Menschen mit Lynch-Syndrom nicht übersehen werden. Um die Kosten zu decken, versuchen die Forscher, MSI oder IHC direkt anhand der Art und Weise vorherzusagen, wie der Tumor unter dem Mikroskop aussieht, ohne molekulare Tests durchzuführen.
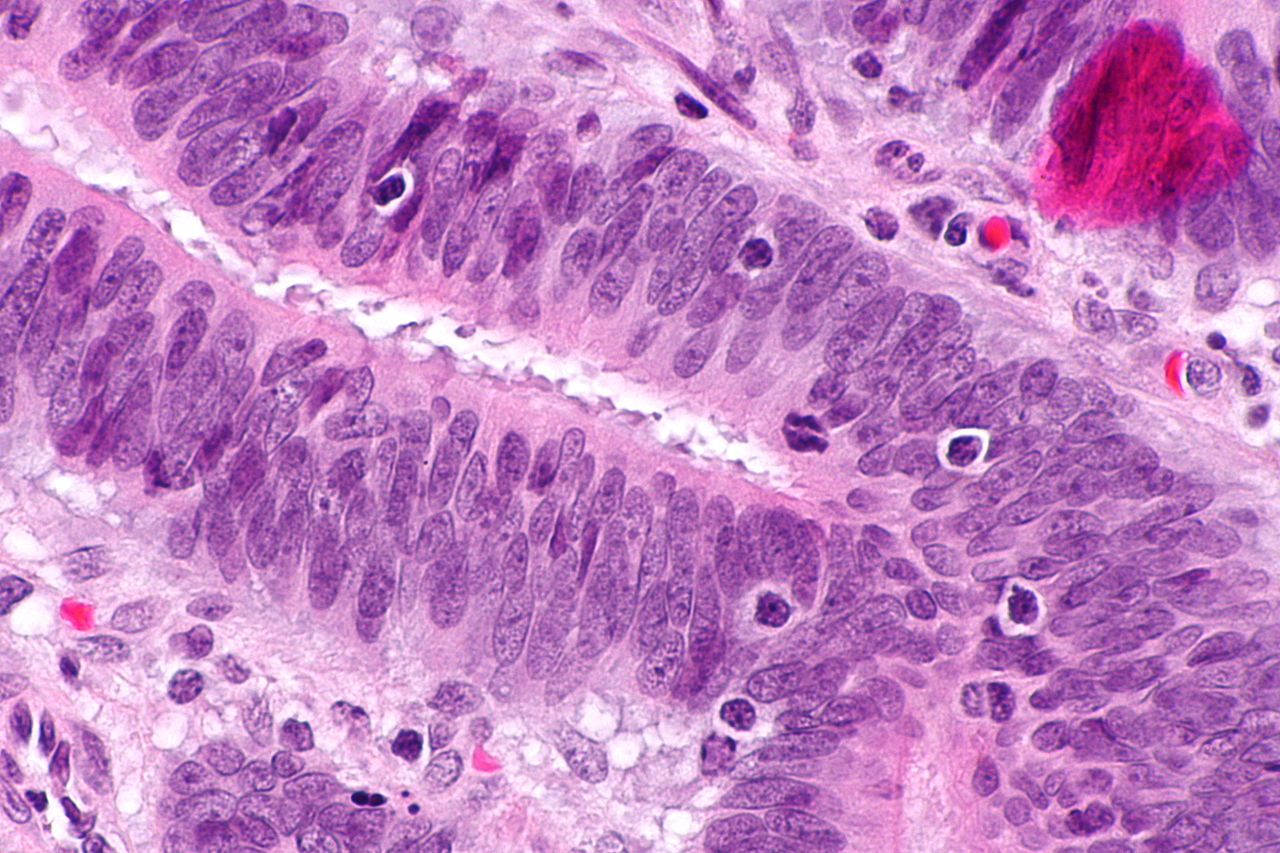
Mikrosatelliteninstabilität
Mutationen in DNA-Fehlpaarungsreparatursystemen können zu Schwierigkeiten bei der Übertragung von Regionen innerhalb der DNA führen, die sich wiederholende Muster von zwei oder drei Nukleotiden (Mikrosatelliten) enthalten, die auch als Mikrosatelliteninstabilität (MSI) bezeichnet werden. MSI wird durch DNA-Extraktion sowohl aus einer Tumorgewebeprobe als auch aus einer normalen Gewebeprobe identifiziert, gefolgt von einer PCR-Analyse von Mikrosatellitenregionen. Mithilfe der MSI-Analyse können Personen mit Lynch-Syndrom identifiziert und für weitere Tests angewiesen werden.
Einstufung
Drei Hauptgruppen von MSI-H-Krebs (Mikrosatelliteninstabilität – MSI) können anhand histopathologischer Kriterien erkannt werden:
- rechtsseitig schlecht differenzierte Krebsarten
- rechtsseitige Schleimhautkrebserkrankungen
- Adenokarzinome an jeder Stelle, die einen messbaren Gehalt an intraepithelialen Lymphozyten (TIL) aufweisen
Die histopathologischen Kriterien sind nicht empfindlich genug, um MSI aus der Histologie zu erkennen, aber Forscher versuchen, mithilfe künstlicher Intelligenz MSI aus der Histologie vorherzusagen.
Darüber hinaus kann HNPCC in Lynch-Syndrom I (familiärer Dickdarmkrebs) und Lynch-Syndrom II (HNPCC in Verbindung mit anderen Krebsarten des Magen-Darm-Trakts oder des Fortpflanzungssystems) unterteilt werden.
Verhütung
Screening-Test
Genetische Beratung und Gentests werden für Familien empfohlen, die die Amsterdamer Kriterien erfüllen, vorzugsweise vor dem Auftreten von Darmkrebs.
Darmkrebs
Koloskopien werden als vorbeugende Überwachungsmethode für Personen mit Lynch-Syndrom oder LS-assoziierten Genen empfohlen. Insbesondere wird empfohlen, dass Koloskopien für MLH1- und MSH2-Mutationsträger im Alter von 20 bis 25 Jahren und für MSH6- und PMS2-Mutationsträger im Alter von 35 Jahren beginnen. Die koloskopische Überwachung sollte dann bei Patienten mit Lynch-Syndrom im Abstand von 1 bis 2 Jahren durchgeführt werden.
Endometrium- / Eierstockkrebs
Ein transvaginaler Ultraschall mit oder ohne Endometriumbiopsie wird jährlich für das Screening von Eierstock- und Endometriumkrebs empfohlen. Bei Frauen mit Lynch-Syndrom kann ein jährlicher CA-125-Bluttest zum Screening auf Eierstockkrebs verwendet werden. Es liegen jedoch nur begrenzte Daten zur Wirksamkeit dieses Tests bei der Verringerung der Mortalität vor.
Andere Krebsarten
Es gibt auch Strategien, um andere Krebsarten frühzeitig zu erkennen oder die Wahrscheinlichkeit ihrer Entstehung zu verringern, die Menschen mit Lynch-Syndrom mit ihrem Arzt besprechen können. Ihre Wirksamkeit ist jedoch nicht klar. Diese Optionen umfassen:
- Obere Endoskopien zur Erkennung von Magen- und Dünndarmkrebs alle 3–5 Jahre, frühestens ab dem 30. Lebensjahr (vorzugsweise in einem Forschungsumfeld)
- Jährliche Urinanalyse zur Erkennung von Blasenkrebs, frühestens ab dem 30. Lebensjahr (vorzugsweise in einem Forschungsumfeld)
- Jährliche physische und neurologische Untersuchungen zur Erkennung von Krebs im Zentralnervensystem (Gehirn oder Rückenmark), frühestens ab dem 25. Lebensjahr
Amsterdamer Kriterien
Das Folgende sind die Amsterdamer Kriterien zur Identifizierung von Hochrisikokandidaten für molekulargenetische Tests:
Amsterdam I Kriterien (alle Stichpunkte müssen erfüllt sein):
- Drei oder mehr Familienmitglieder mit einer bestätigten Diagnose von Darmkrebs, von denen eines ein Verwandter ersten Grades (Eltern, Kind, Geschwister) der beiden anderen ist
- Zwei aufeinanderfolgende betroffene Generationen
- Ein oder mehrere Darmkrebserkrankungen, die unter 50 Jahren diagnostiziert wurden
- Eine familiäre adenomatöse Polyposis (FAP) wurde ausgeschlossen
Die Amsterdam II-Kriterien wurden 1999 entwickelt und verbesserten die diagnostische Empfindlichkeit für das Lynch-Syndrom durch Einbeziehung von Krebsarten des Endometriums, des Dünndarms, des Ureters und des Nierenbeckens.
Amsterdam Criteria II (alle Aufzählungspunkte müssen erfüllt sein):
- Drei oder mehr Familienmitglieder mit HNPCC-bedingten Krebserkrankungen, von denen eines ein Verwandter ersten Grades der beiden anderen ist
- Zwei aufeinanderfolgende betroffene Generationen
- Einer oder mehrere der HNPCC-bedingten Krebsarten, die unter 50 Jahren diagnostiziert wurden
- Eine familiäre adenomatöse Polyposis (FAP) wurde ausgeschlossen
Chirurgie
Eine prophylaktische Hysterektomie und Salpingo-Oophorektomie (Entfernung der Gebärmutter, der Eileiter und der Eierstöcke, um die Entwicklung von Krebs zu verhindern) kann durchgeführt werden, bevor sich Eierstock- oder Endometriumkrebs entwickelt.
Behandlung des Lynch-Syndroms
Die Chirurgie bleibt die Front-Line-Therapie für HNPCC. Patienten mit Lynch-Syndrom, die an Darmkrebs erkranken, können entweder mit einer partiellen Kolektomie oder einer totalen Kolektomie mit ileorektaler Anastomose behandelt werden. Aufgrund des erhöhten Darmkrebsrisikos nach partieller Kolektomie und einer ähnlichen Lebensqualität nach beiden Operationen kann eine totale Kolektomie eine bevorzugte Behandlung für HNPCC sein, insbesondere bei jüngeren Patienten.
Es gibt eine anhaltende Kontroverse über den Nutzen von 5-Fluorouracil-basierten adjuvanten Therapien für HNPCC-bedingte kolorektale Tumoren, insbesondere in den Stadien I und II.
- Eine Anti-PD-1-Antikörpertherapie kann wirksam sein.
Die Checkpoint-Blockade mit Anti-PD-1-Therapie ist jetzt die bevorzugte Erstlinientherapie bei fortgeschrittenem Mikrosatelliten-Instabilitätskrebs mit hohem Darmkrebs.
.


















Discussion about this post